Química

La química es de gran importancia en muchos campos del conocimiento, como la ciencia de materiales, la biología, la farmacia, la medicina, la geología, la ingeniería y la astronomía, entre otros.
Objetivos de la química
- Comprender la importancia de la química como ciencia natural que nos sirve para otras ciencias y permite satisfacer necesidades.
- Entender todo lo relacionado a la materia (Estructura, Componentes, propiedades, etc)
- Saber diferenciar las propiedades de la materia y su estructura.
- Realizar la investigación científica aplicando el método científico.
- Distinguir las relaciones que encontramos entre materia y energía.
- Ser capaz de entender los fenómenos que se producen y que en cierta forma modifican de un modo permanente las propiedades de la materia.

Análisis: es la descomposición o desintegración de los materiales más frecuentes usamos para las investigaciones.
Síntesis: es el proceso por el cual se producen compuestos químicos a partir de simples o precursores químicos.
Relación de la Química con otras Ciencias
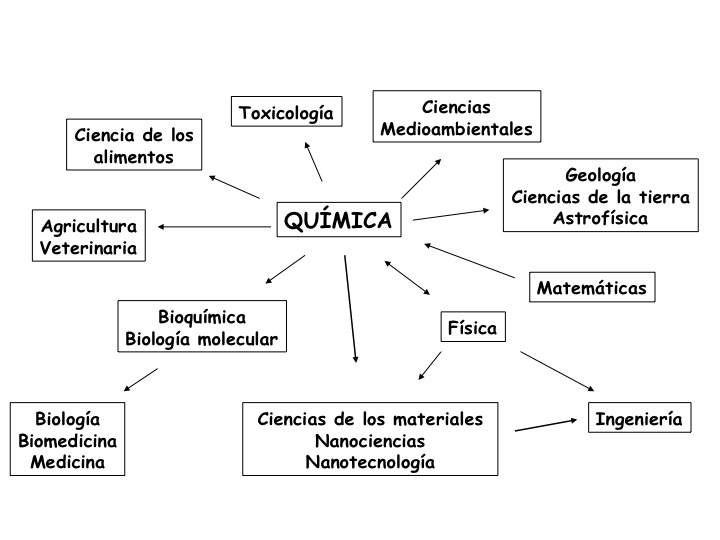
Beneficios de la Química
Los beneficios de la química junto con las otras ciencias nos brinda muy buenos beneficios para nuestro bien estar y estos beneficios son:
- Fertilizante es un tipo de nutrientes en forma química saludable y asimilable por la raices de las plantas.
- Investigación y desarrollo de nuevos medicamentos.
- Nuevas formulas para plásticos mas elásticos.
- Desarrollo energéticos para poder dejar de usar los fósiles.
- Artículos de limpieza personal.
Riesgos de la Química
Los riesgos de la química afecta la salud de los trabajadores por la toxicidad de ciertos elementos del ambiente.
- Irritación
- Asfixia
- Narcóticos
- Pulmonares
- Mutageno
- Teratogeno
Actividades que nos exponen a riesgos químicos
- Experimentos en laboratorios
- Elaboración de químicos
- Limpiezas con productos químicos
- Elaboración de pesticidas
Normas para reducir riesgos químicos
- Mantener el debido control al elaborar productos inflamable
- Utilizar el debido atuendo para los químicos
- Colocar el sello de peligro en cada uno de los productos
- Mantenerlos fuera del alcance de los niños
Materiales Peligros: Hazmat
Los accidentes mas comunes en el laboratorio, derivados de la utilización de reactivos son:
- Quemaduras (llama, ácidos, álcali, etc)
- Gases Toxicos
- Exposición a radiaciones perjudiciales
- Cortaduras con vidrios u otros objetos con bordes afilados
Clases de Química
- Química General
- Química Inorgánica
- Química Orgánica
- Química Analítica
- Química Física
- Química Ambiental
Métodos Científico
Materia
Es todo aquello que tiene un lugar en el espacio, posee una cierta cantidad de energía.
- Energía: es la capacidad y fuerza para actuar física o mentalmente
- Cuerpo: es porción limitada de materia con forma determinada
- Sustancias:es toda porción de materia que comparte determinadas propiedades intensivas. Se emplea también el término para referirse a la clase de materia de la que están formados los cuerpos.
- Mezcla: es un sistema material formado por dos o más componentes unidos, pero no combinados químicamente.
- Homogéneas: son las que están formadas por dos o mas componentes pero solo se presentan por una sola fase.
- Heterogéneas: son las que están formadas por dos o mas componentes pero que se presenta en dos o mas fases.
- Sistema Material: es una porción específica de la materia, confinada en una porción de espacio, y que se ha seleccionado para su estudio.

Propiedades de la Materia
Se clasifican en :
- Físicas: son las que se pueden determinar sin alterar la identidad de la sustancia. Pueden ser:
- Generales: son la inercia, elasticidad, impenetrabilidad, discontinuidad, indestructibilidad, divisibilidad.
- Particulares: son la densidad, dureza, maleabilidad, ductilidad, viscosidad.
- Químicas:es cualquier propiedad en que la materia cambia de composición, se oxida, combustión, se inflama
Propiedades Organolépticas
- Color: se distingue por la vista. (azul, rojo, negro)
- Olor: por el olfato
- Sabor: por el gusto (salado, dulce , amargo)
- Sonido: por el oído (ruido, música)
- Impresión al tacto: por la mano ( liso, áspero. rugoso)
No depende de la cantidad de materia:
- Color
- Olor
- Densidad
- Cambios de estados de agregación de la materia
- Dureza
- Solubilidad
- Conductividad
- Maleabilidad
- Ductibilidad
Propiedades Ectensivas
Si depende de la cantidad de materia:
- Masa
- Inercia
- Peso
- Volumen
- Elasticidad
- Impenetrabilidad
- Divisibilidad
Cambios Físicos
- No varía la composición química de la materia
- Lo que se tiene al principio se tiene al final
- No se formar nuevas sustancias
Cambios Químicos
- Alteran la composición química de la materia
- Originan otras sustancias
Estados de la Materia
- Solido: sus fuerzas de cohesión de sus moléculas son mayores que las fuerzas de repulsión
- Líquido: sus fuerzas de cohesión son iguales a la fuerzas de dispersión
- Gaseoso: sus fuerza de dispersión son mayores que las fuerzas de atracción en las moléculas de los gases
- Fusión: de solido a liquido
- Solidificación: de liquido a solido
- Vaporización: de liquido a gaseoso
- Condensación: de gaseosa a liquida
- Sublimación: de solido a liquido
ENERGIA
Capacidad que tiene la materia de producir trabajo de movimiento, luz, calor y fuerza para actuar fisica o mentalmente. Es la capacidad de los cuerpos para producir cambios en ellos mismos o en otros cuerpos.
La energia se manifiesta en cambios fisicos y cambios químicos.

Tipos de energía
Energía química: es la que se produce en las reacciones químicas.
Energía eléctrica: es causada por el movimiento de las cargas electricas en el interior de los materiales conductores.
Energía luminosa: es la que se transporta por la luz.
Energíasolar: es la que llega a la tierra en forma de radiación electromagnética.
Energía mecánica: se refiere al movimiento del cuerpo.
Energía hidráulica: es aquella que se obtiene del aprovechamiento de las energías cinética y potencial de la corriente del agua, saltos de agua o mareas
Energía nuclear: es la energía que se libera espontánea o artificialmente en las reacciones nucleares
Energía electromagnética: se define como cantidad de energía almacenada en una parte del espacio.
Energía eólica: se la obtiene a tra vez del viento.
Ley de la conservación de la masa
Establece que en una reacción química la masa inicial es igual a la masa final independientemente de los cambios que se produzcan, es decir que la masa de los reactivos es igual a la masa de los productos.
De esta ley se deriva que en una reacción química debe conservarse el número y la clase de átomos, de modo que estos solo se reordenan para formar nuevas sustancias.
LEY DE LA CONSERVACIÓN DE LA ENERGÍA.
Ley de la conservacion de la enrgía
Constituye el primer principio de la termodinámica. Su teoria plantea que la energia no se crea ni se destruye, unicamente se transforma.

UNIDADES: SISTEMA INTERNACIONAL
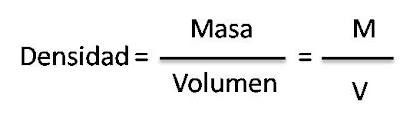
Densidad de un material
La diferentes particulas que existen en la naturaleza están conformadas por particulas que según las condiciones de presion y temperatura en las que se encuentran definiran el estado de la materiay una condicion muy caracteristica.
Energia potencial: la gravedad es una constante de 9.8 m/s2
UNIDADES: SISTEMA INTERNACIONAL
Densidad de un material
La diferentes particulas que existen en la naturaleza están conformadas por particulas que según las condiciones de presion y temperatura en las que se encuentran definiran el estado de la materiay una condicion muy caracteristica.

Energia potencial: la gravedad es una constante de 9.8 m/s2
Ep
= m. g.h
Energia cinética:
Energia mecanica:
Em = Ep + Ec
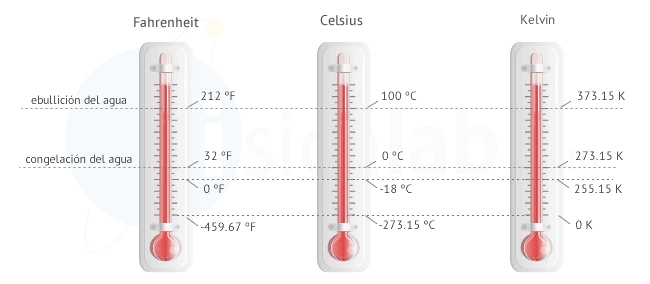
UNIDADES DE MEDIDA DE TEMPERATURA
Es una magnitud fisica que refleja el calor.




Clasificacion de los metales
Son 7 elemntos cuyas caracteristicas son intermedias entre los metales y no metales.
Sólidos a temperatura ambiente.
Enlaces

1.Enlaces quimicos
Los enlaces quimicos, son las fuerzas que mantienen unidos a los atomos.
Cuando los átomos se enlazan entre si, ceden, aceptan o comparten electrones. Son los electrones de valencia quienes determinan de que forma se unirá un atomo con otro y las caracteristicas del enlace.
2. Regla del octeto.
EL ultimo grupo de la tabla periodica VIII A (18), que forma la familia de los gases nobles, son los elementos mas estables de la tabla periodica. Esto se deben a que tienen 8 electrones en su capa mas externa, excepto el Helio que tiene solo 2 electrones, que tambien se considera como una configuracion estable.
3. Enlace
ionico
Ec
= ½.m.v2
Energia mecanica:
Em = Ep + Ec
UNIDADES DE MEDIDA DE TEMPERATURA
Es una magnitud fisica que refleja el calor.

Modelos Atómicos
Números Cuanticos

Tabla Periodica

Tabla Periodica
Clasificacion de los metales
- Metales alcalinos
- Metales alcalinoterreos
- Metales de transicion
- Metales del grupo 13 al 15
- Lantánidos
- Actínidos
No Metales
- Halógenos
- Anfígenos
- Nitrogeno
- Carbonoides
Son 7 elemntos cuyas caracteristicas son intermedias entre los metales y no metales.
Sólidos a temperatura ambiente.
Enlaces
1.Enlaces quimicos
Los enlaces quimicos, son las fuerzas que mantienen unidos a los atomos.
Cuando los átomos se enlazan entre si, ceden, aceptan o comparten electrones. Son los electrones de valencia quienes determinan de que forma se unirá un atomo con otro y las caracteristicas del enlace.
2. Regla del octeto.
EL ultimo grupo de la tabla periodica VIII A (18), que forma la familia de los gases nobles, son los elementos mas estables de la tabla periodica. Esto se deben a que tienen 8 electrones en su capa mas externa, excepto el Helio que tiene solo 2 electrones, que tambien se considera como una configuracion estable.
Los
elementos al combinarse unos con otros, aceptan, ceden o comparten electrones
con la finalidad de tener 8 electrones en su nivel más externo,
esto es lo que se conoce como la regla del octeto.
|
- Esta formado por metal + no metal
- No forma moleculas verdaderas, existe como un agregado de aniones (iones negativos) y cationes (iones positivos).
- Los metales ceden electrones formando por cationes, los no metales aceptan electrones formando aniones.
Los compuestos formados
pos enlaces io;nicos tienen las siguientes caracteristicas:
- Son solidos a temperatura ambiente, ninguno es un liquido o un gas.
- Son buenos conductores del calor y la electricidad.
- Tienen altos puntos de fusion y ebullicion.
- Son solubles en solventes
polares como el agua
| Disposicion de los iones en un cristal de cloruro de sodio | Modelo de esperas y varillas de un cristal de cloruro de sodio. El diametro de un ion cloruro es alrededor del doble del de un ion de sodio | El cloruro de sodio es un solido cristalino de forma cubica que tiene un punto de fisiòn de 808 grados C |